Aux quatre coins du globe, les questions fusent quant à la distinction entre l’eau douce et l’eau dure et leur effet sur la façon de nourrir les plantes et le contenu de cette nourriture.
Selon le Ministère des Affaires Intérieures Américain et le Service Géologique des États-Unis (U.S. Geological Survey –USGS-), toute eau contenant 60 mg/L (60 ppm) ou moins de certains ions est considérée comme de l’eau douce. En revanche, une eau qui contient 120 mg/L (120 ppm) est considérée dure, et tout ce qui se trouve entre les deux est modérément dure. D’autres pays et agences maintiennent leurs propres distinctions (Voir le Tableau 1). À proprement parler, il s’agit de la concentration d’ions métalliques plurivalents positifs dissous possédant une charge de +2 ou +3, notamment le calcium et le magnésium. Cet effet peut être intensifié par la présence de dioxyde de carbone (CO2) dissous dans l’eau, comme les carbonates et les bicarbonates
Eau dure, eau douce, mauvaise eau! Quelle est la différence? Tout ce qui est dissous dans l’eau réagit avec les autres éléments ajoutés dans l’eau, ou tout ce avec quoi elle entre en contact. L’eau dure pose un problème pour le nettoyage et pour les équipements en plus d’augmenter l’activité chimique de l’eau, surtout en ce qui a trait au pH; toutefois, cette eau est souvent considérée comme plus saine pour les humains. De façon générale, l’eau dure provient d’une source souterraine qui a été exposée à de la roche minérale pendant une période prolongée. L’eau de puits en est le parfait exemple.
L’eau douce, pour sa part, permet au savon de mousser et de mieux fonctionner. Elle pose moins de problèmes pour les équipements et donne carte blanche aux réactions chimiques. Des études ont démontré une corrélation entre l’eau douce et les problèmes de santé, dont les maladies cardiovasculaires. En général, cette eau provient des sources de surface, des fleuves, des rivières et des lacs qui n’ont pas été exposés à des formations rocheuses minéralisées durant une longue période. On obtient également de l’eau douce en la traitant pour éliminer la plupart des ions ou les remplacer par des atomes univalents comme le sodium à l’aide d’un adoucisseur d’eau.
Ions problématiques
On dit d’une eau qu’elle est de mauvaise qualité lorsque son contenu en sel est élevé ou lorsqu’elle contient des produits chimiques indésirables. On en trouve un peu partout, surtout dans les zones industrielles, les régions très agricoles et près des étendues d’eau salée. Cela n’a toutefois aucune incidence sur la dureté de l’eau.
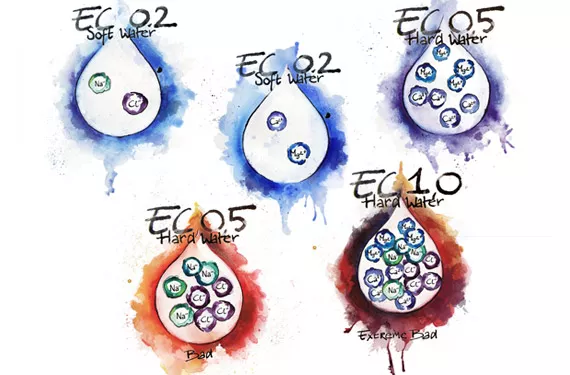
Il ne faut pas confondre la concentration d’ions ou de sels avec la dureté ou la douceur de l’eau. La dureté est une fonction des ions plurivalents comme le Ca2+ et le Mg2+, et non des ions monovalents comme le Na+ ou le Cl+. Les ions monovalents apparaissent aussi dans les matières totales dissoutes (MTD) d’une solution, il est donc possible d’avoir des MTD de 450 mg/L (1 ppm = 1 mg/L) en ajoutant du sel de table à de l’eau distillée, mais être quand même en présence d’une eau douce.
Il n’y a aucune corrélation directe entre les MTD ou la CE (conductivité électrique) et la dureté de l’eau, sauf si la CE découle exclusivement du Ca, du Mg ou d’autres ions métalliques plurivalents positifs. L’eau sucrée possède une CE, mais aucune dureté. Les adoucisseurs d’eau fonctionnent ainsi en chassant les ions problématiques tels que le calcium et le magnésium avec des ions de sodium. La CE demeure inchangée ou augmente, mais l’eau dure devient douce; une situation indésirable pour les plantes.
En ce qui nous concerne, la grande question demeure: comment la dureté de l’eau affecte-t-elle les nutriments donnés à nos plantes? Un des effets les plus significatifs de l’eau dure sur les systèmes de culture est la possibilité que des dépôts insolubles de carbonates de calcium ou de magnésium se forment. La combinaison de ces ions se produit par réaction endothermique, c’est-à-dire que, lorsque la solution est chauffée, le processus s’accélère. Le pompage de l’eau du réservoir pour passer dans la pompe, dans les petits tuyaux, sur la table et au travers du système racinaire fait augmenter la chaleur de la solution, donc cette réaction se produit naturellement et continuellement.
Blocage des goutteurs
Alors que la chaleur entre dans le système, les éléments se combinent plus rapidement, provoquant ainsi la formation de dépôts insolubles à l’intérieur des pompes, des tuyaux, des tubes et du support dans le système de culture. Ultimement, on observe la réduction du débit le blocage des goutteurs, l’épuisement des pompes, etc.
La composition chimique de l’engrais peut aussi être influencée par diverses relations antagonistes entre les ajoute de calcium et de magnésium. Plus ces éléments potassium et phosphore, sont disponibles car taux de carbonate, l’effet sur le pH se poursuivra dans le support. Plus l’eau est dure, plus on aura besoin d’acide pour abaisser le pH.
Table 1:
Limites maximales de facteurs chimiques recommandées dans l’eau d’irrigation pour la culture en serre. (Basé sur 1 et 2, voir la bibliographie)

Il existe deux méthodes commerciales pour régler divers problèmes de concentration et de dureté. La première étant l’adoucisseur d’eau. L’adoucissement de l’eau consiste à envahir l’eau avec un ion monovalent, habituellement le sodium, qui s’occupe d’expulser le calcium pour réduire la dureté de l’eau. Cette méthode procure d’excellents résultats pour la lessive et le bain, mais pour la consommation par les plantes et les humains, les résultats ne sont pas aussi bons, surtout lorsque l’eau est très dure.
La deuxième méthode se nomme l’osmose inverse (OI), un processus par lequel l’eau du robinet est filtrée au travers d’une série de membranes avec des pores de plus en plus petits qui permettent de bloquer les molécules et les atomes d’une certaine taille. Ce processus filtre efficacement le calcium et d’autres éléments plus gros, réduisant ainsi la dureté de l’eau. Il supprime également la plupart des éléments, dont les molécules dangereuses, les ions de sodium et la plupart des autres ions, réduisant ainsi grandement les matières totales dissoutes et la CE. L’installation et l’entretien de cet appareil sont dispendieux et il n’est pas toujours nécessaire d’utiliser de l’eau d’osmose pure.
Échantillon d’eau
Les fabricants d’engrais consciencieux devraient prendre en considération la dureté de l’eau lors de la conception de leurs produits, car chaque système a des besoins différents à cet égard. C’est surtout type de support utilisé qui dicte ces différences. Les mélanges de rempotage ont un grand pouvoir de tamponnage et sont capable de retenir les éléments, on ne doit donc pas les utiliser dans un système à recirculation. La recirculation augmente la chaleur dans le système et provoque la formation rapide de dépôts. Les mélanges de rempotage ont un agent tampon naturel qui réduit les fluctuations de pH. Le contenu de l’engrais doit donc être ajusté et avoir les bonnes proportions de nutriments de façon à s’adapter précisément aux mélanges de rempotage.
Seule l’eau douce est recommandée pour les systèmes à recirculation avec supports inertes, donc l’eau d’osmose pure convient dans ce cas-ci. Les systèmes à recirculation doivent pouvoir s’ajuster non seulement à la dureté de l’eau, mais surtout aux éléments supplémentaires présents dans l’eau du robinet, qui s’ajoutent à l’apport nutritif de l’engrais. Le contrôle de la composition des sels est crucial, car il affecte aussi le pH et le pH est essentiel pour stimuler la réponse florale d’une plante (en plus des changements de photopériode). La meilleure solution est d’utiliser un engrais conçu pour l’eau du robinet avec une CE d’au plus 0,3 à 0,4 mS/cm contenant agent de tamponnage pour contrôler le pH dans le système (par exemple, CANNA AQUA).
D’autre part, il existe des systèmes ouverts (Run-To-Waste), aussi très populaires, dans lesquels les nutriments mélangés dans le réservoir sont administrés à la plante de façon à ce que tout surplus soit ensuite drainé hors du système sans être réutilisé. Dans ce type de système, il est important de régler le pH lorsque la solution est mélangée en plus de maintenir le pH tant et aussi longtemps que la solution préparée demeure dans le réservoir. Ceci réduit les fluctuations de pH tout en empêchant la formation de composés insolubles. De plus, comme les ions de calcium et de magnésium sont moins disponibles dans l’eau douce, on doit augmenter ou remplacer les quantités pour obtenir la bonne disposition d’ions. Pour faciliter la culture et alléger vos soucis quant à la composition des nutriments, vous devriez utiliser une marque d’engrais qui vous offre des formules pour eau douce et pour eau dure pour les systèmes ouverts (comme CANNA SUBSTRA). Comment savoir si l’on doit utiliser la formule pour eau douce ou la formule pour eau dure? Facile, vous n’avez qu’à lire les explications ci-dessus et prélever un échantillon d’eau.
Donc, qu’est-ce que nous apportent de telles connaissances? La capacité de reconnaître que plusieurs aspects influencent la qualité de l’eau. La quantité totale d’ions dissous n’est pas le seul obstacle à surmonter, la composition des éléments, leur effet sur les engrais et les réactions chimiques qui peuvent et vont se produire sont tous des aspects non négligeables. Ultimement, c’est la plante qui en subit les répercussions. Les engrais doivent être conçus et utilisés en se basant sur le type d’eau que l’horticulteur compte utiliser. En outre, on doit utiliser des engrais correctement formulés pour répondre aux besoins nutritifs de la plante et permettre le développement à long terme, en plus de connaître les effets que le support aura sur la composition, l’emmagasinage et la réactivité des engrais. Tester pour savoir, savoir pour cultiver! Que savez-vous?
Bibliographie
- Baily, D, T Bilderback, and D Bir. “Water considerations for container production of plants.” North Carolina State University Horticulture Information Leaflet 557. 1996.
- Kessler Jr., J. R. “Water Quality Management for Greenhouse Production.” Alabama Cooperative Extension Service Publication ANR-1158. Alabama A&M and Auburn University, 2005.